新興感染症に挑む、
技術開発の系譜
シリーズ・企業探訪⑱
テルモ
写真/猪飼 ひより(amana)
シリーズ・企業探訪⑱
テルモ
今なお全世界で猛威をふるう新型コロナウイルス感染症(COVID-19)。新興感染症のパンデミックという危機に世界中の人々が混乱に陥るなか、国内ではECMO(エクモ)が重症患者の7割の生命を救い、ラストホープとして注目を集めています。ECMOはどのような目的で開発され、いかにして「生命を守るテクノロジー」となりえたのでしょうか。ECMOの国内シェア7割を誇るテルモで、PCPS/ECMOの開発に当たった押山広明さんに伺いました。
2020年1月に中国・武漢市でCOVID-19が拡大し、日本でも感染拡大が危惧されるというニュースを、押山さんはどのように受け止められましたか。
2009年から2010年にかけて新型インフルエンザウイルスによるパンデミック(世界的大流行)が発生したとき、世界的にECMO*1 による治療が見直され、重症呼吸不全をきたして死に直面した多くの患者さんの救命に寄与しました。
押山 広明(おしやま・ひろあき)/テルモハート株式会社代表取締役社長、テルモ株式会社カーディオバスキュラー事業East Asia本部アドバイザー。専攻は化学工学。1986年テルモ株式会社入社。志望動機は「専攻が人工臓器に活かせそうだと思ったから」。研究員として人工肺「キャピオックスE」、遠心ポンプ、PCPSカテーテル、PCPS心肺キット、血液回路設計支援システムなどの開発に携わる
https://www.terumo.co.jp
その当時、国内でも各地の医療機関でテルモのECMOをお使いいただいたのですが、この製品はもともと心肺停止などの際に、緊急的に心臓機能を補助することを意識して開発したデバイスであり、重症呼吸不全に対する使用経験が十分ではなかったことから、諸外国に比べ満足のいく治療成績を示すことができませんでした。実際、社内外でECMOではなく「PCPS*2 」という名称の方が広く認識されていたことから、同じ製品であるにも関わらず、PCPSという名称の通り、本来意図していた用途とは異なるかたちで使用されたことが見て取れます。
*1 ECMO
体外式膜型人工肺(Extracorporeal Membrane Oxygenation)の略。人工肺と血液ポンプを使用した心肺補助システムや治療法の総称。体外循環による生命維持装置であることから、ECLS(体外生命維持装置:Extracorporeal Life Support)とも呼ばれる。肺炎が重症化し、急性呼吸窮迫症候群(ARDS)などの重症呼吸不全をきたした患者の肺機能をサポートしたり、急性心筋梗塞など心臓の疾患を発症した患者の心機能と肺機能の両方をサポートしたりする。
*2 PCPS
経皮的心肺補助法(Percutaneous Cardiopulmonary Support)の略であり、心肺補助用途で使用する際のECMOの別称。特に心臓疾患を抱える患者に使用し、心機能と肺機能の両方をサポートする場合はこの名称が用いられる。皮膚の上から血管にカテーテルを挿入するという意味で名付けられた。
こうした反省を踏まえ、新型インフルエンザの治療に当たられた先生がたのご意見をうかがいながら「PCPS/ECMO」として重症呼吸不全の治療に使用する際の留意点、デバイスの改良などについて検討を重ね、有用性を向上させるよう努めてきました。
現行のPCPS/ECMO
新型インフルエンザと同様に、COVID-19においても重症呼吸不全をきたして死に至る症例が報告されていました。そんななか、「JAMA(米国医師会雑誌:T
PCPS/ECMOのしくみとはたらきを理解するため、まずは本来、肺と心臓が私たちの生命活動を維持するために果たしている役割についてご説明いただけますか。
私たちは、胸腔と腹腔をへだてる薄い筋肉の膜である横隔膜が上下に動き、肺を膨らませたり縮ませたりすることで呼吸しているわけですが、その基本的な役割は空気中に含まれる酸素を取り入れ、代わりに二酸化炭素を排出する「血液—ガス交換」を行うことです。
血液—ガス交換は、気管支が肺のなかで細かく枝分かれした末端にブドウの房のようにつらなる球状の肺胞と、それを取り囲む毛細血管を流れる血液の間で行われます。
心臓と肺(イメージ)
©︎ 3D4MEDICAL.COM /amanaimages
肺胞(イメージ)。成人男性の肺胞の総数は、およそ6億個。それぞれは直径0.1 mm〜0.2 mmで、すべて広げると60 ㎡〜70 ㎡、テニスコート約1面分の面積に達する
©︎ PASIEKA/SCIENCE PHOTO LIBRARY /amanaimages
肺胞を囲む膜(肺胞上皮)には多数の小さな孔が開いていて、酸素や二酸化炭素といった気体(ガス)だけを通過させます。この肺胞上皮と毛細血管を介し、全身の細胞をめぐって心臓に返ってくる静脈血から二酸化炭素を取り出して呼気とともに排出し、心臓から送り出されて全身の細胞をめぐる動脈血に酸素を供給するというのが肺の基本的な役割です。
なぜ、このような血液—ガス交換が必要なのでしょうか。
重要な臓器や筋肉などの細胞が正常にはたらくためには、食事から摂ったたんぱく質や糖質、脂質などの栄養素を動脈血中のヘモグロビンによって運搬された酸素を使って二酸化炭素と水に酸化分解します。その過程で、ATP(アデノシン三リン酸)と呼ばれる物質を生成してエネルギーとして利用します。分解された二酸化炭素は、静脈血として肺胞に運ばれることになります。
血液—ガス交換のしくみは、心臓と肺が一体となって休みなく正常にはたらき続けることによって維持されるため、成人の場合、安静時でも1分間に12〜20回呼吸し、心臓が70〜80回拍動することが生命活動を営む条件とされています。
肺が血液—ガス交換を行えなくなり、心臓のはたらきが悪くなると、全身の細胞に酸素が十分に供給されなくなり、たちまち生命に危険がおよぶことになります。
国内のCOVID-19に対するECMOの治療成績をみると、2020年8月現在、ECMOを装着された患者さんのうち、およそ7割が回復してECMOを外せたと言われます。そもそもECMOとはどういう装置で、COVID-19が重症化した*3 患者さんに、どのように使われるのでしょうか。
参考:国内のCOVID-19におけるECMO治療の成績累計(日本COVID-19対策ECMOnet、2020年8月18日現在)。青は「回復(ECMO離脱)」、黒は「死亡」、赤は「ECMO実施中」を示している
https://crisis.ecmonet.jp/
*3 肺炎重症化の背景
COVID-19や新型インフルエンザの重症呼吸不全の一因は、「サイトカインストーム」と呼ばれる過剰な炎症反応ではないかと考えられている。サイトカインストームとは、免疫細胞からIL-1、IL-6、TNFαなど炎症性のサイトカイン(生理活性物質)が体内で過剰に産生されること。本来、炎症性サイトカインはウイルスを攻撃する役割を担うが、その攻撃は同時に生体にもダメージをおよぼす。多量の炎症性サイトカインが血流に乗って全身に運ばれると、心臓、腎臓、肝臓、脳などの臓器が侵されて「多臓器不全」をきたすリスクが高まるとされている。
参考:日本医師会COVID-19有識者会議 平野俊夫「新型コロナウイルス感染症(COVID-19)はサイトカインストーム症候群である」(2020年5月28日)
https://www.covid19-jma-medical-expert-meeting.jp/topic/1968
COVID-19やインフルエンザのようなウイルス性の肺炎が重症化すると、肺胞周囲の間質(かんしつ)という組織が侵され、肺胞のなかに水がたまる肺水腫を起こしたり、肺胞の膜が肥厚して硬くなる線維化を起こしたりするとされています。
こうして自発呼吸では十分な血液—ガス交換ができなくなった患者さんに対し、最初に行われるのは人工呼吸器で肺に空気より高い濃度の酸素を送り込むことです。しかし、これはあくまでも患者さんご自身の肺の機能を補助する治療法です。
これに対し、ECMOは静脈から抜いた血液をいったん体外に取り出して人工肺で血液—ガス交換を行い、遠心ポンプで静脈もしくは動脈に戻すことにより、患者さんご自身の肺や心臓が本来のはたらきを回復するまで休ませるという発想から生まれた治療法です。
テルモのPCPS/ECMO(VA-ECMO)のしくみ。静脈から脱血して動脈に返血する方法をとっている。遠心ポンプと人工肺で患者の心臓と肺の機能の一部を代行して回復を待つ
(画像提供:テルモ株式会社)
人工呼吸器が肺の機能の一部を「補助」するのに対し、ECMOは肺や心臓の機能の一部を「代行」して生命を維持するための装置というわけですね。ECMOは、そもそも医療現場のどのようなニーズにより開発されてきた装置なのでしょうか。
ECMOの源流は、急性心筋梗塞や弁膜症などの治療のため、米国を中心に心臓手術が行われ始めた1950年代にさかのぼります。
こうした手術は心臓を止めた状態で行う必要があるのですが、心臓と肺は一体としてはたらいていますので、心臓を止めるということは肺の機能も止めることになります。そこで、心臓手術を行う際、一時的に心臓と肺の機能を代行する人工心肺装置の開発が求められました。
人工心肺装置を使用した最初の心臓手術が成功したのは1953年、米国でのことです。以後、1960年代にかけて人工肺を使用した心臓手術が世界で盛んに行われるようになりましたが、当初の人工肺はガラス容器のなかに血液を通し、下から酸素の泡を噴き上げたり、ステンレスでできたメッシュ状の器具をいくつも並べて上から血液を流し、横から酸素を吹き付けたりする方式でした。
ところが、血液は空気や異物に触れると血液中にある凝固因子と呼ばれるたんぱく質や血小板のはたらきによって凝固し、血栓と呼ばれる血のかたまりができて血管が詰まり、脳梗塞などの血栓症を引き起こす可能性があります。そのため、異物である器具が血液に触れ、また回路に空気が混入しやすいこうした方法では、短い時間の手術にしか耐えられませんでした。
実際、当時の人工心肺装置を使用した患者さんのなかには、心臓手術の成否にかかわらず術後に血栓症を合併して亡くなられる方が少なからずいらっしゃいました。
人工心肺装置を使うときは、こうした合併症を防ぐためにヘパリンという血液凝固を防ぐ薬剤(抗凝固薬)が併用されています。しかし、ヘパリンの用量が多すぎると逆に出血しやすくなり、脳出血や消化管出血などのリスクが高まるというジレンマがあります。
人工心肺装置として開発された技術をECMOとして使用するうえで、克服すべき課題とはどのようなものだったのでしょうか。
ECMOの話をする前にまず、人工心肺装置における人工肺の進化についてお話しします。短い時間の心臓手術にしか対応できない、血栓症や出血を起こしやすくなるという課題を踏まえ、長い時間にわたって安全かつ効果的に血液—ガス交換ができる人工肺をつくる必要がありました。
こうした医療現場のニーズに応じ、1970年代初めに提唱されたのが「膜型人工肺」という概念です。ガス透過性の高いシリコンゴム製の膜、多数の小さな孔が開いた平膜、直径0.2 mm〜0.3 mmのストロー状の中空糸を束ねた「中空糸膜」などを使用することによって、生体の肺胞の膜に近い、より生理的な人工肺の開発が進められました。
この膜型人工肺が心臓手術で普及していくとともに、同様の技術を使用したECMOが重症呼吸不全の際に使用されるようになりました。これ以降、米国や英国、スウェーデンなどにある「ECMOセンター」と呼ばれる専門施設を中心に、成人の重症呼吸不全に対するECMOの研究や治療が継続されましたが、1980年代までに行われた臨床試験では、人工呼吸器に優る治療成績を示せませんでした。
一方、横隔膜に先天性の障害がある新生児などに対するECMOの治療成績はきわめて良好でした。成人の重症呼吸不全において十分な有用性が示せなかったのは、ひとつには成人の肺胞のはたらきに匹敵する血液—ガス交換が行える膜型人工肺を実用化するのが難しかったからだと考えられています。
テルモは、どのように膜型人工肺を改良していったのでしょうか。
テルモでは1960年代にディスポーザブル(使い切り)の注射器や輸血のための血液バッグなどの製造を手がけ、70〜80年代以降は慢性腎不全治療のための血液透析、心筋梗塞の治療のための血管内カテーテルやステント、人工血管、人工心肺、人工心臓などのデバイスやシステムの開発を進めてきました。
このような血液に触れる医療機器を開発するにあたっては、血液や血管内が異物による炎症反応に起因する合併症を起こす懸念が少ない、生体適合性のよい素材を厳選することが重要です。
こうした研究開発の流れのなかで、テルモは1982年、世界に先駆けて心臓手術の際に使用する「多孔質中空糸膜(マイクロポーラス・ホローファイバー)型人工肺」の開発に成功しました。すでにあった平膜人工肺に比べて構造がシンプルで、ガス交換性能の安定性に優れていたため、安定して使用できたことから、国際的にも高い評価を受けました。
右上の円筒形の部品が、現行のPCPS/ECMOに使用されている「中空糸膜(ホローファイバー)型人工肺」。微小な孔が多数開いたポリメチルペンテン製の中空糸を束ねて作った人工肺で、中空糸の外側には、0.001 mm程度の厚みのスキン層を有しており、血液中の血しょうは通さず、内側に酸素や二酸化炭素のガスだけを通す
ホローファイバー型人工肺のしくみ。血しょうを通さないスキン層を設けることで、中空糸の膜面が目詰まりを起こさず、長時間にわたり効率よく均一な「血液—ガス交換」を可能にする(画像提供:テルモ株式会社)
この膜型人工肺の開発が、結果的にPCPS/ECMOの実用化につながるマイルストーンとなったわけですね。救急医療用のPCPS/ECMOは、どのような経緯で開発されたのでしょうか。
1980年代後半に米国の心臓治療では著名なクリーブランドクリニックの心臓血管外科の先生がたから「心臓が全身に血液を循環させることができなくなり、ショック状態に陥った患者さんを救うための装置を開発したいので協力してほしい」というお話をいただいたのがきっかけです。この開発はEBS(緊急用補助循環システム:Emergency Bypass System)という名称でスタートしました。
同施設と海外の製品の情報も共有しながら開発を進め、プロトタイプを作製しました。その後、国内での複数の施設との連携を進め、PCPSの製品化に漕ぎつけたのは1995年のことです。
開発初期のPCPS/ECMO(画像提供:テルモ株式会社)
社内ではEBSとして開発を進めていましたが、当時の日本の医療機関ではPCPSの名称で呼ばれていました。手術で大きく胸を開いたりすることなく、経皮的(Percutaneous)に心肺補助を行う、つまり皮膚の上から血管にカテーテルを挿入することで心肺補助が可能なシステムだったからです。
どのように使われるのでしょうか。
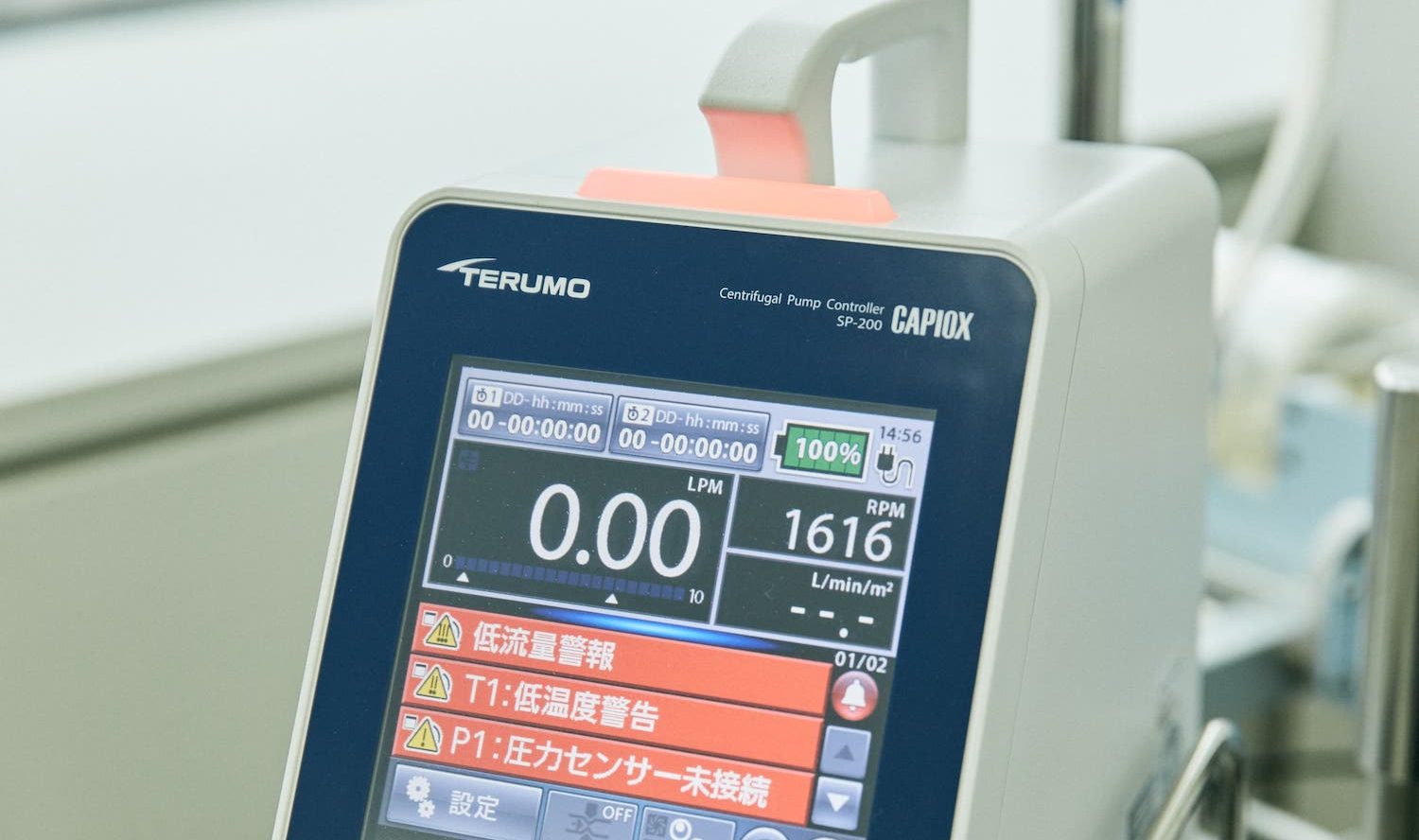
PCPS/ECMOは、本体のコントローラー、ディスポーザブルの遠心ポンプと人工肺、脱血用と送血用のカテーテルで構成されるシステムです。
PCPS/ECMOのディスポーザブル製品。遠心ポンプ、人工肺と回路
(画像提供:テルモ株式会社)
コントローラーには、医師が患者さんに必要な酸素を供給するために設定した遠心ポンプの回転数と血流量、人工肺による循環時間などが表示され、循環状態や回路の異常を知らせるアラーム機能が備わっています。
PCPS/ECMOのコントローラーには異常や人工肺の使用時間を知らせる機能が備わっている
静脈に挿入する脱血用のカテーテルと、動脈に挿入する送血用のカテーテルは、患者さんの静脈、動脈の太さに合ったものを選択し、血管内に挿入する長さは調節します。
急性心筋梗塞の手術は一刻を争います。開発にあたって念頭に置いたのは、心肺停止状態となって救急搬送された患者さんに対し、カテーテルをなるべく血管や血液を傷つけることなく、安全かつすみやかに挿入する方法を見出すことでした。
脱血用と返血用のカテーテルはそれぞれサイズが3種類あり、静脈を示す青、動脈を示す赤に色分けされている。あらかじめヘパリンを加えた生理的食塩水で濡らした上で、まず血管に刺した直径1.3 mmの導入針からガイドワイヤーを挿入。これに沿ってプレダイレーターという樹脂でできた円筒状のデバイスを入れ、血管の穿刺孔(せんしこう)を拡張する。プレダイレーターを抜き取ったあと、ガイドワイヤーに沿ってダイレーターとカテーテルを挿入し、ダイレーターとガイドワイヤーを抜き取りカテーテルを留置する。脱血用と返血用のラインにそれぞれのカテーテルをつなぐ
PCPS/ECMOを普及させるために、テルモではどのような取り組みをしてきたのでしょうか。
1991年に発足した「日本経皮的心肺補助研究会(PCPS研究会)」など、学術集会やセミナーでPCPS/ECMOを安全かつ有効にお使いいただくための研究報告や討議、研修に積極的に参加しています。
また、神奈川県足柄上郡中井町にある「テルモメディカルプラネックス」という施設に、実際の病棟や手術室、カテーテル治療室を模した研修設備があり、医療に従事される専門職の方々にテルモの製品やシミュレーターなどを使ったトレーニングの機会を提供しています。
テルモメディカルプラネックスでの医療従事者トレーニングの様子
(画像提供:テルモ株式会社)
おかげさまで、PCPS/ECMOは現在、国内で500施設を超える医療機関に1,000台以上導入されており、年間約7,000例の症例にお使いいただいています。
これは余談ですが、『ドクターX ~外科医・大門未知子~』というテレビドラマで米倉涼子さん演じる主人公が、「PCPS!」と叫ぶシーンがあり、画面に私たちの製品が登場したこともあるんです(笑)。
2009〜10年のインフルエンザ・パンデミックからCOVID-19までの臨床経験の蓄積によって見出された、ECMOを重症呼吸不全に使用するときの留意点とはどのようなものでしょうか。
最も大切なのは、ECMOによる治療を「いつ開始するか」ということです。
患者さんが重症呼吸不全をきたした場合、まず人工呼吸器による呼吸管理を行いますが、高濃度の酸素を1週間にわたって投与しても重症化が抑えられなかったあとでは、たとえECMOを使用しても回復が難しいと指摘されています。
ECMOは体外で血液を循環させるという観点では侵襲の大きい方法ですので、安易に導入するものではありません。ただし、診療の手引き書においては、人工呼吸器を装着しても十分な酸素が取り込めなくなり、呼吸不全が悪化した段階でECMOの使用を考慮することが推奨されており、その目安となる臨床的な指標*4 も示されています 。
*4 新型コロナウイルス感染症診療における指標
日本集中治療医学会など3学会で構成される「日本COVID-19対策ECMOnet」では、肺の線維化が進み、人工呼吸を行っても血液-ガス交換が十分にできなくなった患者はECMOによる治療に移行することが求められている。
参考:厚生労働省「新型コロナウイルス感染症(COVID-19)診療の手引き・第2版」(2020年5月18日)P22
https://www.mhlw.go.jp/content/000631552.pdf
テルモでは2020年1月にはすでにPCPS/ECMOの部材の調達を開始し、日本政府から増産の要請があった4月には平時の3倍の生産が可能な体制を整えていたとお聞きしています。新型コロナウイルス感染症の対策に医療機器メーカーとして貢献していることを、どのように感じていらっしゃいますか。
テルモは第一次世界大戦の影響で輸入が途絶えた良質な体温計を国産化するため、北里柴三郎*5 博士をはじめとする医師らが発起人となって1921年に設立されました。北里博士は当時、結核が国民病であったこと、戦争中にスペイン風邪がパンデミックを起こしたことなどから、感染症の診療に必要な医療機器を供給したいという強い思いがあったのだろうと想像します。そこから今日にいたるまで、一貫して「医療を通じて社会に貢献する」という企業理念のもとに事業を展開してきました。
北里柴三郎博士
©︎ Science Photo Library/amanaimages
*5 北里柴三郎(1853-1931)
医学者、細菌学者。1885年にドイツに留学し、のちに「近代細菌学の開祖」と称されるコッホに師事した。1889年、破傷風菌の純粋培養に世界で初めて成功。翌1890年には血清療法を開発し、世界的な医学研究者となった。帰国後は伝染病研究所を設立し、1894年にはペスト菌を発見するなど、感染症医学の発展に多大な貢献をした「日本の細菌学の父」として知られる。
2021年9月に創立100周年を迎えようとするいま、COVID-19という新興感染症の対策に貢献する製品の開発に携わることができたのは、創業の精神、企業理念に沿ったチャレンジだったと思っています。

メディカルジャーナリスト。医学、医療を主分野に40年近く取材・執筆に携わり、感染症をテーマにした著書もある。「循環器領域の取材をする機会が多く、テルモの製品は興味深く拝見してきました。押山さんのお話をうかがい、来年、創業100周年を迎える同社の成り立ちと国産ECMOの開発が見事に共鳴しているのに驚きました。これはコロナの夜に光をともす、もう1つの『プロジェクトX』だと思います」

amanaフォトグラファー。「ECMOを拝見させていただき、
https://amana-visual.jp/photographers/Hiyori_Ikai
Instagram:@ikaihiyori

NATURE & SCIENCE 編集部。「うまく呼吸ができなくなったときの恐怖や苦しみは、程度の差はあれど多くの人が身に覚えのあることではないでしょうか。今なお世界中で闘っているCOVID-19患者の皆さまを、ECMOが一人でも多く救ってくれることを願ってやみません」